新能源行业当前包含风能、太阳能、动力和储能电池,当前最火的当属动力和储能电池,动力电池和储能电池当前又属锂离子电池最火。下面个人根据已有资料重新整理一下锂离子电池的发展历程。
一、最轻的金属
锂元素是在1817年被瑞典化学家贝齐里乌斯的学生阿尔费特逊发现,贝齐里乌斯将其命名为锂。到1855的年本生和马奇森采用电解熔化氯化锂的方法才得到金属锂单质,工业化制锂是在1893年由根莎提出的。锂从被认定是一种元素到工业化制取前后历时76年。现在电解LiCl制取锂,仍要消耗大量的电能,每炼一吨锂就耗电高达六、七万度。
锂在他出世后的100多年中,它主要作为抗痛风药服务于医学界。美国特种航天特种局(NASA)是最早从事锂原电池研究的,这是因为他们分析表明锂电池能够以最小的体积提供最高的电压。根据P=UI,锂具有很高的能量密度,因此锂电池是一种高效的电池。
电池电压是和负极金属活泼性密切相关的,作为非常活泼的碱金属,锂电池能提供较高的电压。比如锂电池可以提供3V的电压,②铅蓄电池只有2.1V,而碳锌电池只有1.5V。锂所具有的另一个特点就是“轻“。锂的密度是0.53g/cm3,它是所有金属中最轻的一个,轻到在煤油里也能浮起来。作为3号元素,自然界存在的锂由两种稳定的同位素6Li和7Li组成,因此锂的相对原子质量只有6.9。这就意味着在在质量相同时,金属锂比其它活泼金属能提供更多的电子。此外,锂元素还有另外一个优点。锂离子离子半径小,因此锂离子比其他大的离子更容易在电解液中移动。
金属锂尽管有很多优点,但是制造锂电池还有很多需要克服的困难。首先,锂是非常活泼的碱金属元素,能和水以及氧气反应,而且常温下它就能与氮气发生反应。对于这样一个顽皮的家伙,要保存它是十分困难的,它不论是在水里,还是在煤油里,都会浮上来燃烧.化学家们最后只好把它强行捺入凡士林油或液体石蜡中。这就导致金属锂的保存、使用或是加工都比其他金属要复杂得多,对环境要求非常高。所以,锂电池长期没有得到应用。随着科学技术的发展,锂电池的技术障碍一个个突破,锂电池渐渐也登上了舞台,锂电池随之进入了大规模的实用阶段
二、金属锂电池
1958年,哈里斯(Harris)考虑到锂作为碱金属会与水以及空气发生反应,提出了采用有机电解质作为金属锂电池的电解质。根据电池的相关工作要求,有机电解液溶剂需要具备三个性质,①溶剂为极性溶剂,锂盐在极性溶剂的溶解度较大,从而电解液的电导率较大;②溶剂必须是非质子的极性溶剂,因为含质子的溶剂容易和锂发生反应;③溶剂要有较低的熔点和较高的沸点,从而使得电解液有尽可能宽的温度范围。这一构想的提出立即得到科学界的广泛认可,并引发了不小的研发热潮。
在金属锂一次电池的开发中,初期选择传统正极材料,如Ag、Cu、Ni的化合物的电化学性能一直达不到要求,人们不得不寻找新的正极材料。1970年,日本Sanyo公司就是利用二氧化锰作为正极材料在造出了人类第一块商品锂电池。1973年松下开始量产正极活性物质为氟化炭材料作正极的锂原电池。1976年,以碘为正极的锂碘原电池问世。接着一些用于特定领域的电池如锂银钒氧化物(Li/Ag2V4O11)电池也相继出现,这种电池主要用于植入式心脏设备。上世纪80年代以后,锂的开采成本大幅度降低,锂电池开始商业化。
早期金属锂电池属于一次电池,这种电池只能一次性使用、不能充电。锂电池的成功极大地激发了人们继续研发可充电电池的热情,开发锂二次电池的序幕就此拉开。1972年,美国埃克森(Exxon)公司采用二硫化钛作为正极材料,金属锂作为负极材料,开发出世界上第一个金属锂二次电池。但是在循环过程中金属锂表面容易形成锂枝晶,刺穿隔膜导致内短路,容易起火爆炸。尽管锂二次电池一度成功实现了产业化,但是由于安全问题最终退出市场。
为了解决这个问题,Armand在1977年的专利中提出了石墨嵌入化合物可以充当锂离子电池负极材料,随后于1980年提出正负极均采用嵌入式化合物作为电极材料,充放电过程中锂离子在正负极之间做往复运动,它将这种电池形象的成为摇椅式电池,这即是锂离子电池的雏形。同年,Mizushima等提出LiCoO2(钴酸锂)层状化合物具有用于锂离子电池正极材料的可能性。
最早实现锂离子电池操作的是Monino等,他们在一系列文献报道中报道了采用TiS2和WO3等材料为正极, LiWO2LiWO2 和LiFeO3等材料为负极,LiClO4溶于碳酸丙烯酯(PC)为电解液的锂离子电池。这类电池中的典型反应可用下式表示:
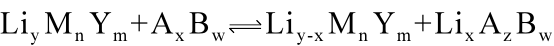
这种电池的开路电压和充放电效率高,但是容量低,动力学性能差,负极材料Li LiyMnYmLi_{y}M_{n}Y_{m} 需要由Li与 MnYmM_{n}Y_{m} 用电化学方法制备,再与正极 AzBwA_{z}B_{w} 构成电池。由于是采用氧化还原反应的反应物装配电池,负极在空气中不稳定,因此难以实现产业化。
1987年AuBorn和BarBerio用可直接制备的氧化还原反应产物 LiCoO2LiCoO_{2} 做正极,实现了直接装备电池,然而仍未解决负极充电速率低的问题。知道1990年,索尼公司用石油焦作负极,大幅度提高了负极充放电的充放电速率,次年成功推出了商品化的锂离子电池。晶体碳石墨材料虽然很早就被应用于锂离子电池的研究,但玉玉石墨与电解液中PC反应强烈,一度处于停滞状态。受到低晶碳工业化的鼓舞,人们通过改进电解液,研发出以碳酸乙烯酯(EC)为基础的电解液,使晶体碳随之实现工业化,标志着锂离子电池主导电池体系的形成。
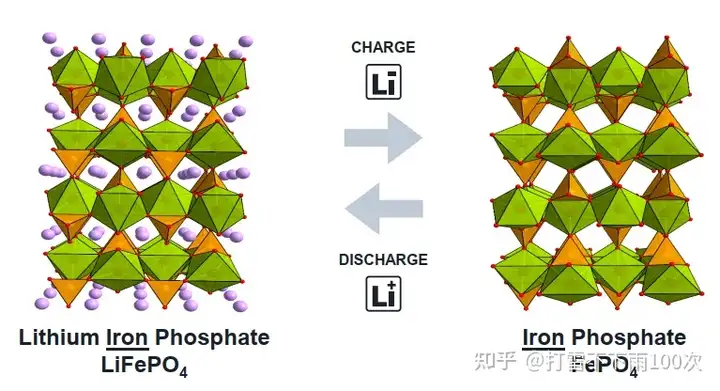
其他研究者也在不断探索能够用于电极的材料。Goodenough课题组在1983年提出尖晶石装 LiMn2O4LiM_{n2}O_{4} 可作为锂离子电池正极材料,1996年提出橄榄石结构 LiFePO4LiFePO_{4} 作为锂离子电池正极材料的构想。
1996年加拿大Zaghib首次提出采用钛酸锂作为电池负极材料;
1997年由Numata首先提出富锂猛基材料 Li2MnO3Li_{2}M_{n}O_{3} . LiCoO2LiCoO_{2} 可作为电池正极材料;
1997年富士公司首次报道非静态锡基负极材料;
1999年Liu首次报道了 LiNi1−x−yCoyMnxO2LiNi_{1-x-y}Co_{y}Mn_{x}O_{2} (即镍钴锰,0<x<0.5,0<y<0.5)三元过渡金属镍钴锰复合氧化物可作为电池正极材料;
1999年日本索尼公司成功实现聚合物锂离子电池大规模产业化生产。
2001年Ohzuku等首次固相合成了具有优良性能的钛酸锂作为电池负极材料。
2005年日本索尼公司首次制备出以碳包覆Co-Sn作为电极材料的“NexeLion”锂离子电池。
三、锂离子电池特点
与传统二次电池相比,锂离子电池的质量比和体积比能量高,约为MH-Ni电池的2倍;循环使用寿命长;工作电压高,通常工作电压为3.2V(磷酸铁锂)和3.7V(三元锂),约为MH-Ni和Cd-Ni电池的3倍;使用温度范围宽,能在-20~60℃之间工作,且高温下放电性能优良;无记忆效应,可随时进行充放电而不影响容量;自放电低,远低于MH-Ni和Cd-Ni电池的自放电率;不含有重金属汞、铅、镉等有害有毒元素,环境友好。锂离子电池的缺点主要是成本较高,必须有保护电路,以防止过充电。
3.1锂离子电池的组成
制造锂离子电池的主要原材料包括正极材料、负极材料、隔膜和电解液等,同时还包括导电剂、粘结剂、壳体、集流体和电极引出端子等通用辅助材料。锂离子电池的制造就是将这些原材料加工组装成电池的过程。
3.2正极材料
在锂离子电池充放电过程中,正极材料发生电化学氧化/还原反应,锂离子反复地在材料中嵌入和脱出。锂离子电池正极材料种类繁多,常见的正极材料主要有钴酸锂(LiCoO2)、锰酸锂(LiMn2O4)、磷酸铁锂(LiFePO4)和三元锂。当前市场使用最多的是磷酸铁锂和三元材料。
3.3负极材料
在锂离子电池充放电过程中,锂离子反复地在负极材料中嵌和脱出,发生电化学氧化/还原反应。为了保证良好的电化学性能,对负极材料一般具有如下的要求:
①锂离子嵌入和脱出时电压较低,使电池具有高工作电压;
②质量比容量和体积比容量较高,使电池具有高能量密度;
③主体结构稳定,表面形成固体电池电解质界面(SEI)膜稳定,使电池具有良好循环性能;
④表面积小,不可逆损失小,使电池具有高充电效率。
⑤具有良好的离子和电子导电能力,有利于减少极化,使电池具有大功率特性和容量。
锂离子电池负极材料种类繁多,能够满足上述要求且实现商业化的负极材料主要有石墨、硬碳和软碳等材料,钛酸锂、硅基和锡基材料。
石墨材料
(1)组成结构,石墨是有碳原子组成的六角网状平面规则平行堆砌而成的层状机构晶体,属于六方晶体,P63/mc空间群。
3.4隔膜
3.5电解质
电解质是电池的重要组成部分之一,是在电池内部正、负极之间起到寄哪里离子导电通道,同时阻隔电子导电的物质,因为锂离子电池的电化学性能与电解质的性质密切相关。锂离子电池通常采用有机电解质,稳定性好,电化学窗口宽,工作电压通常比使用水溶液电解质的电池高出1倍以上,接近4V左右。这些特性使锂离子电池具备了高电压和高比能量的性质。但是有机电解质导电性不高,热稳定性差,导致锂离子电池存在安全隐患。
要保证锂离子电池具有良好的电化学性能和安全性能,电解质体系需要具备如下特点:
①在较宽的温度范围内,锂离子导电率高、锂离子迁移数大,交闪电池在充放电过程中的浓差极化,提高倍率性能。
②热稳定性好,保证电池在合适温度范围内使用。
③电化学窗口宽,最好具有0~5V的电化学稳定窗口。
④电化学性性质稳定,保证电解质在两极不发生显著的副反应,满足在电化学过程中电极反应的单一性。
⑤电解质代替隔膜使用时,还要具有良好的力学性能和可加工性能。
⑥安全性好,闪点高或不燃烧。
⑦价格成本低,无毒物污染,不会对环境造成危害。
四、动力电池在汽车上的应用
起源汽车采用电池作为动力,并不是从2010年之后特斯拉开始的,发展历程是这样的:1、1839年的英格兰,一个叫罗伯特·安德森就制造出人类历史上第一辆采用铅酸电池的电动汽车, 在之后的几十年间,汽车的技术路线一直在蒸汽机汽车,汽油机汽车以及电动汽车三者之间交替发展。2、1970年代末期,M.S. Whittingham在美国埃克森研究实验室中开发了第一个锂离子电池的原型,这是锂电池技术的最初起步。3、1980年代初期,约翰·古德纳夫(John B. Goodenough)在德州大学奥斯汀分校开发出了第一种具有实用价值的锂离子电池,使用锰酸锂作为正极材料和碳作为负极材料。4、1990年代,Akira Yoshino在松下电器产业株式会社研发了首个商业化锂离子电池,采用了石墨负极和锂钴氧化物正极,并获得了锂电池技术的重要专利。5、2000年代,锂电池开始广泛应用于便携式电子产品,如手机、笔记本电脑等,同时也被用于电动汽车和储能系统等领域。6.2010年代,随着新能源产业的崛起和能源转型的加速,锂电池的需求不断增长,技术不断发展,新材料、新工艺、新应用等也不断涌现。
2012年,特斯拉电动车的火热,使锂离子电池再次吸引了全球的目光,特斯拉的电池包由16个电池组串联而成,每个电池组由444节锂电池组成,其中74节为并联。因此,特斯拉ModelS电池包共由7104节18650节锂电池组成。而18650正是由日本松下原来给笔记本电池等电子产品设计的锂离子电池,其中18表示直径为18mm,65表示高度为65mm,0表示为圆柱形电池。根据正极材料的不同(三元和磷酸铁锂),其电压等级又分为3.2V(磷酸铁锂材料)和3.7V(三元材料),单颗电芯容量分为2000mAh/2600mAh/3000mAh不等。
随着特斯拉的带动作用,2010年之后全球开始逐渐进入锂离子电池大发展,根据电池的外壳不同,分为软包、方壳、圆柱。其中方壳主要是国内厂家宁德时代和比亚迪为代表,软包主要是LG、三星SDI,圆柱主要为日本松下,三种技术路线在全球市场评分秋色。
2、中国动力电池的崛起(摘自第一财经)
中国锂电产业的萌芽集中于1994~1999年,大体可以归结为全球锂电产业链从欧美到日、韩、中国台湾再到中国大陆迁移的浪潮带动。消费锂电四巨头比亚迪、比克、ATL和力神都诞生于那一时期。
2008年,彼时奥运会上亮相了搭载锰酸铁锂电池的50辆电动大巴车,这是动力电池在国内汽车上的首次应用,这条技术路线源于日本,后来朝着更高能量密度的三元锂电池发展。
在日韩发展朝向三元锂电池技术路线时,以美国A123系统公司为代表的磷酸铁锂技术路线开始兴起。随着2012年美国A123系统公司申请破产,三元锂电池逐渐在国际上得到广泛认可。但彼时,中国市场更看重电池安全性能,此后很长一段时间内磷酸铁锂电池占据了主流。
相较于三元锂电池,虽然在能量密度上不占据优势,但磷酸铁锂电池具备成本低、安全性高、循环寿命长的优点,加上在中国电动车发展初期应用场景更偏向于商用车,磷酸铁锂技术路线成为当时电池厂的首选,比亚迪就是当时国内最大的磷酸铁锂电池制造商。
这一时期,比亚迪、宁德时代、比克、沃特玛、国轩高科等国内电池企业快速发展,但由于过度押注磷酸铁锂技术和产能盲目扩张,其中一些企业也在短短数年之后因技术路线的切换破产倒闭。不同的是,宁德时代始终锁定在三元锂电池的研发上,这也为其后期快速成长奠定了基础。
需要说明的是,同时期全球范围来看三元铁锂仍是行业主流。中国动力电池第一次崛起也来自于三元铁锂对磷酸铁锂的替代。原因是电池能量密度提高之后,电动乘用车能够实现300多公里的续航里程,满足了网约车市场的需求。
2015、2016年,国家引导政策逐步加大对电池能量密度的考核,这导致磷酸铁锂技术路线进一步的失势。2017年,比亚迪电池装机量首次被宁德时代超越,大批磷酸铁锂动力电池材料企业的破产,一些企业破产背后更多的原因还包括政策红利期的盲目扩张。
坚持研发三元锂电技术的宁德时代在这一时期迅速发展,成为政策变化的最大受益者。2017年,宁德时代以17%的市场份额摘得全球第一的桂冠。国际巨头LG与松下被甩在了后面。而在国内,此前常年盘踞销冠之位的比亚迪,也因为技术路线变化沦落为老二。
此后,开启了宁德时代为王的时代,后面的一些列厂家(重创新航、国轩高科、欣旺达、风潮能源等)你追我赶的时代。
五、当前动力电池的创新发展方向
5.1材料创新
高镍电池
钠离子电池
钠离子电池(Sodium-ion battery),是一种二次电池(充电电池),主要依靠钠离子在正极和负极之间移动来工作,与锂离子电池工作原理相似。在充放电过程中,Na+在两个电极之间往返嵌入和脱出:充电时,Na+从正极脱嵌,经过电解质嵌入负极;放电时则相反。
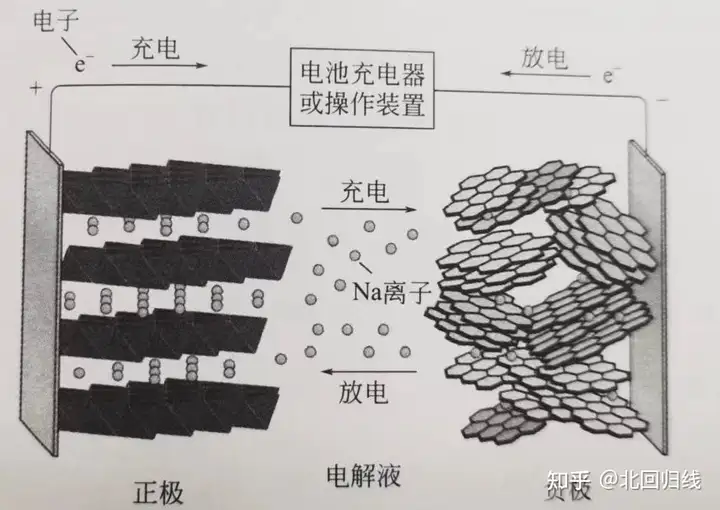
钠离子特点:钠和锂属于同族,两者具有相似的物理和化学性质。其中钠具有丰富的储量(地壳中含量约为2.64%,而锂含量仅占地壳的0.006%),价格低廉(锂的原材料碳酸锂大约比钠的基本原材料天然碱鬼30~40倍),明企钠电极电位比锂高0.3V,具有更加稳定的电化学性能,使用更加安全。因此,从成本、能耗、资源等角度来说,钠离子电池在规模化储能方面具有更大的市场竞争优势和广阔的发展前景。
与锂离子电池相比,钠离子电池具有的优势有:(1)钠盐原材料储量丰富,价格低廉,采用铁锰镍基正极材料相比较锂离子电池三元正极材料,原料成本降低一半;(2)由于钠盐特性,允许使用低浓度电解液(同样浓度电解液,钠盐电导率高于锂电解液20%左右)降低成本;(3)钠离子不与铝形成合金,负极可采用铝箔作为集流体,可以进一步降低成本8%左右,降低重量10%左右;(4)由于钠离子电池无过放电特性,允许钠离子电池放电到零伏。钠离子电池能量密度大于100Wh/kg,可与磷酸铁锂电池相媲美,但是其成本优势明显,有望在大规模储能中取代传统铅酸电池。
前不久(23年4月份),宁德时代借着上海车展的东风,发布了钠离子电池和凝聚态电池产品。号称能够“杀死燃油车”的凝聚态电池作为目前动力电池行业最先进的技术之一,前景自不用提。但更值得关注的,是被宁德时代评价为“具备高能量密度、高倍率充电、优异的热稳定性、良好的低温性能与高集成效率等优势”,“既可应用于各种交通电动化场景,尤其在高寒地区具有突出优势,又可灵活适配储能领域全场景的应用需求”的钠离子电池。
随着宁德时代在车展上宣布其钠离子电池首发落地奇瑞车型,钠离子电池迎来产业化。

镁离子电池
镁元素和锂元素在化学性质方面有许多共同支出,并且具有安全性高、价格便宜(约为锂的1/24)、环境友好等优点,被认为很有发展前景的储能材料。镁离子电池是参照锂离子电池制造出来的,其理论比容量可以达到135Wh/kg,工作电压为1.0~1.3V,工作区间温度为-20℃~80℃,可以达到2000次循环。由于镁离子价态为+2 价,相对于锂离子而言,镁离子的半径更小,电荷密度更大,锂离子溶剂化十分严重,所以镁离子很难在正极材料中实现脱嵌,并且镁离子在材料中的迁移速度缓慢。因此,镁离子电池及其电极材料的研究进展相对缓慢。
截止目前,尚未有镁离子电池量产的消息。
固态和半固态电池
5.2结构创新
刀片电池
大圆柱电池
麒麟电池
麒麟电池不将水冷板放在底部,而是插入电芯间,水冷效果极大加强。好处为①大幅提高安全性,水冷板附加隔热作用,可实现无热扩散。②提升快充性能,电芯双面水冷,4C充电产品23年亮相。③提高比能量,水冷、隔热、缓冲功能三合一,空间得到大幅提升,磷酸铁锂电池包可大160wg/kg,三元高镍可达250wh/kg。比4680电池包多13%的电量。
六、当前动力电池的核心问题
备注:
①部分内容来自网络
②部分内容来自化学工业出版社《锂离子电池制造工艺原理与应用》